| Chlamydomonas reinhardtii |
Chlamydomonas reinhardtii |
Chlorophyta |
Chlamydomonadaceae |
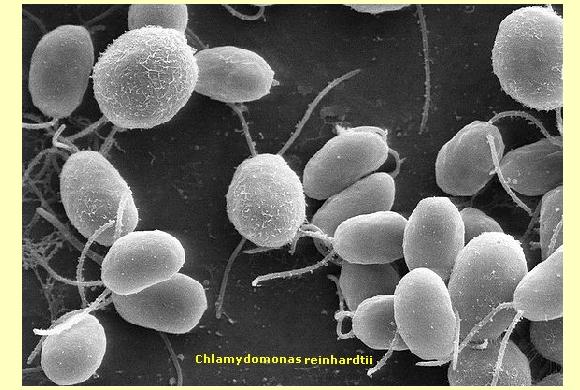 |
Chlamydomonas reinhardtii: Alga eucariote unicellulare, di circa 10 Ám di diametro, che si muove servendosi di due flagelli (lunghi circa 10 ¡Ám).
Classificazione scientifica:
Regno: Plantae
Phylum: Chlorophyta
Classe: Chlorophyceae
Ordine: Chlamydomonadales
Famiglia: Chlamydomonadaceae
Genere: Chlamydomonas
Specie: Chlamydomonas reinhardtii P.A.Dang.
Caratteristiche e ciclo vitale:
C.reinhardtii è molto presente nel suolo e nei bacini di acqua dolce. Presenta una parete cellulare, un ampio cloroplasto ed un occhio (il pirenoide) sensibile alla luce. In genere le varie specie di Chlamydomonas possono essere coltivate in un terreno minimo (con sali inorganici) in presenza di luce (per avviare la fotosintesi). Se somministrato acido acetico, possono crescere anche al buio.
C.reinhardtii è presente per la maggior parte sotto forma di cellule vegetative flagellate, aploidi, con 17 piccoli cromosomi (per un genoma di circa 100 milioni di paia di basi). Se le cellule perdono la fonte di azoto, si formano gameti aploidi. Ci sono due tipi sessuali, identici all'osservazione, chiamati mt(+) e mt(-), che possono fondere e formare uno zigote diploide. Lo zigote non è flagellato, ma rimane dormiente nel suolo: se esposto alla luce, può andare incontro alla meiosi, rilasciando quattro cellule aploidi flagellate, che riprendono la fase vegetativa.
C.reinhardtii è spesso chiamato lievito verde, dal momento che è fotosintetico (e quindi autotrofo), ma presenta caratteristiche molto simili a quelli dei lieviti (come Saccharomyces cerevisiae). Forma agevolmente colonie su piastra, presenta due tipi sessuali (può crescere sia in forma aploide che diploide), permette l'analisi delle tetradi (scoperte proprio in Chlamydomonas) durante la riproduzione e ha una crescita molto rapida (una generazione dura circa 5 ore). In condizioni di crescita ottimali, la cellula può andare incontro anche a due o tre mitosi prima che le cellule figlie vengano rilasciate all'esterno della parete della cellula madre. All'analisi dell'osservatore, così, da un singolo evento riproduttivo sembrano essere prodotte 4-8 cellule figlie.
C.reinhardtii come organismo modello:
La linea cellulare considerata wild-type per l'organismo è chiamata c137 ed è di tipo sessuale mt+. La sua origine non è certa, ma si crede che sia stata raccolta in un campo nel New England negli anni quaranta. Sono noti molti mutanti di C. reinhardtii. I mutanti sono uno strumento utile per studiare un gran numero di processi biologici, come:
 il movimento attraverso flagelli e la regolazione della loro lunghezza;
 la risposta della cellula agli stimoli luminosi;
 i meccanismi di riconoscimento tra due o più cellule;
 la regolazione dell'espressione genica;
 la formazione e l'eredità del cloroplasto;
 la risposta alle variazioni di concentrazione dei sali inorganici presenti;
 qualsiasi processo produttivo.
Per questi motivi, C.reinhardtii è un organismo modello che sta raccogliendo sempre più successo nella comunità scientifica: questa alga è diventato infatti un piccolo caso scientifico, con oltre 100 grandi laboratori nel mondo che hanno iniziato ad usarlo nel giro di pochi anni. La sua attrattiva è aumentata ulteriormente in seguito alla pubblicazione di dati riguardanti il suo genoma. Una prima parte di esso, infatti, è stato diffuso nel febbraio 2003 dal Joint Genome Institute del Dipartimento dell'Energia americano. Sono disponibili le sequenze del genoma nucleare dell'organismo, quasi interamente completato, e quelle dei suoi mitocondri (~15.8 Kb) e dei cloroplasti (~200 Kb). È inoltre disponibile un grande numero di cDNA di sequenze espresse e di ESTs.
Trasformazione di C. reinhardtii:
C. reinhardtii è un organismo molto maneggevole in laboratorio: ciò rende possibili numerose applicazioni biotecnologiche. È infatti un organismo molto semplice da trasformare: la trasformazione può avvenire attraverso ricombinazione omologa nel cloroplasto e non omologa nel nucleo. Il DNA nucleare viene comunemente trasformato attraverso elettroporazione. Il genoma del cloroplasto può essere trasformato, invece, attraverso un approccio biobalistico, sparando microproiettili di DNA nell'organello. Tali procedure rappresentano infatti la via più efficiente di trasformazione del cloroplasto. Ciò è probabilmente dovuto al fatto che il cloroplasto occupa più della metà del volume della cellula, fornendo così al proiettile un bersaglio molto ampio.
C. reinhardtii come fonte pulita di idrogeno:
Grazie anche alle sue caratteristiche di organismo modello per la genetica, numerosi sono i campi di ricerca che utilizzano questo microrganismo al fine di comprendere diversi processi biologici. Uno dei più promettenti è quello legato alla produzione pulita di idrogeno. Qualora fosse possibile utilizzare la microalga per la produzione di grandi quantità di idrogeno a fini energetici, infatti, tale sintesi richiederebbe sostanzialmente le due risorse energetiche primarie sulla terra: l'acqua e la luce. Non ci sarebbe dunque necessità di energia elettrica, né il rilascio di gas serra.
Già nel 1939 il ricercatore tedesco Hans Gaffron (1902-1979), allora alla University of Chicago, descrisse il metabolismo dell'idrogeno nelle alghe verdi unicellulari. C. reinhardtii ed altre alghe verdi sono infatti in grado, in determinate condizioni, di interrompere la produzione fotosintetica di ossigeno e di attivare la produzione di idrogeno per un breve periodo di tempo. Tale reazione, catalizzata da una ferro-idrogenasi, avviene esclusivamente in anaerobiosi. Tale condizione è assolutamente necessaria affinché il processo avvenga, in quanto l'enzima è estremamente sensibile all'ossigeno. Tale elemento, infatti, è in grado di inibirne sia il sito attivo che la sua espressione genica. Dal punto di vista biologico, tale produzione di idrogeno sembra essere essenzialmente una valvola di sfogo per la cellula che, in assenza di ossigeno, si trova ad avere un eccessivo numero di elettroni presso i cloroplasti e li scarta attraverso l'attività della idrogenasi.
Nei trent'anni successivi alla scoperta, il gruppo di Gaffron ha lavorato per chiarire ulteriormente i meccanismi che regolano la produzione di idrogeno da parte delle alghe. Negli ultimi anni, in particolare, il rinnovato interesse per le fonti energetiche rinnovabili ha dato ulteriore impulso alla ricerca in questo ambito, portando alla messa a punto di un primo metodo per rendere efficiente la produzione di idrogeno in C. reinhardtii. La metodica, descritta nel 2000 da Anastasios Melis dell'Università di Berkeley (California, USA), consiste nel privare il mezzo di coltura dello zolfo, un elemento fondamentale per il fotosistema II responsabile della fotolisi dell'acqua. Questa deprivazione porta, nel giro di circa 24 ore, ad una riduzione drastica della fotosintesi e, quindi, della produzione di ossigeno, fino a raggiungere le condizioni di anaerobiosi necessarie per attivare la produzione di idrogeno.
In ogni caso, la durata della sintesi di idrogeno resta un fattore che limita eventuali produzioni di scala di idrogeno a partire dal microorganismo. Il principale motivo di tale brevità è legato al fatto che, dopo pochi minuti, la cellula è in grado di ripristinare la fotosintesi (e dunque la produzione di ossigeno). Per risolvere la questione, attualmente si stanno seguendo due strategie.
Il primo approccio consiste nel disaccoppiamento della idrogenasi dalla fotosintesi. In tal modo, l'accumulo di ossigeno non è più in grado di inibire la idrogenasi. Su questa linea, appare fondamentale la possibilità di poter rendere l'enzima stesso insensibile all'inibizione dell'ossigeno, rendendo possibile una continua produzione di idrogeno.
Una seconda soluzione prevede invece la sospensione temporanea, attraverso manipolazione genetica della idrogenasi, della via fotosintetica. Ciò impedirebbe all'ossigeno di raggiungere un livello tale da inibire la produzione di idrogeno.
Entrambe le vie si sono dimostrate promettenti. In ogni caso, la produzione industriale di idrogeno a partire da microalghe non sembra essere vicina. La resa dei primi prototipi si aggira infatti tra lo 0.5 ed il 3 %, mentre la resa massima di questo processo biologico può essere al massimo del 10 %. |
|